المادة المحددة للتفاعل بحث
- ما هي المواد المحددة للتفاعل والمواد الفائضة؟ - اسألني كيمياء
- بحث عن المادة المحددة للتفاعل الكيميائية – الملف
الكيمياء العامة المبسطة 15, 633 زيارة المادة المحددة للتفاعل ما هي المادة المحددة للتفاعل ؟ المادة المحددة للتفاعل هي المادة التي تستهلك أو تستنزف بالكامل خلال التفاعل الكيميائي قبل أي مادة أخرى. سميت بالمحددة لأنها تحدد أو تقلل من كمية المادة أو المواد الناتجة. مثلا لو فرضنا أن 10 مولات من H 2 تفاعلت مع 7 مولات من O 2 ، فهنا نلاحظ أنه سوف يتكون 10 مولات من H 2 O و يتبقى من المواد المتفاعلة مولين من O 2 ، فهنا نستطيع القول بأن المادة المحدد للتفاعل هي H 2 ، لأنها حدت من سير التفاعل و أيضا حدت من كمية المادة الناتجة. تخيل أنك تريد أن تحضر عدة شطائر بحيث يكون في كل شطيرة:قطعتين من الخبز + 3 شرائح من اللحمة و شريحة و احدة من الجبن و قد لاحظت أن الكميات المتوفرة لديك هي: ثماني قطع من الخبز تسع شرائح من اللحمة خمس شرائح من الجبن فكم عدد الشرائح التي يمكنك أن تحضرها؟ و ما هي المكونات التي سوف تبقى. لحل هذه المشكلة لنرى كم شريحة ممكن أن تحضر من كل مكون. الإجابة هي ثلاث شطائر. فعندما تستهلك شطائر اللحمة سوف تتوقف عن تحضير الشطائر ، و بالتالي شرائح اللحمة هي المكون المحدد لتحضير الشرائح. كما يمكنك ان تلاحظ أن تحضير ثلاث شطائر استهلك ستة قطع من الخبز و ثلاث شرائح من الجبنة و بالتالي تبقى لديك قطعتين من الخبز و شريحتين من الجبن.
ما هي المواد المحددة للتفاعل والمواد الفائضة؟ - اسألني كيمياء
25 − x = 0 ; x = 0. 25 m o l A l = 0. 4 − 2 x = 0. 4 − 2 × 0. 25 = − 0. 1 m o l N. A. نجد أن عدد مولات الألمنيوم الباقية سيكون سالب و هو مرفوض. # لذلك نفرض أن الألمنيوم هو المادة المحددة: = 0. 4 − 2 x = 0; x = 0. 2 m o l ⇒ = 0. 25 − x = 0. 25 − 0. 2 = 0. 05 m o l نجد أن بقي 0. 05mol من أوكسيد الحديد بالتالي يكون الألمنيوم هو المادة المحددة والفرض صحيح.. - حساب عدد مولات الناتجة والمتبقية: - نحسب عدد مولات المادة الناتجة و أوكسيد الحديد المتبقي يحسب ذلك بدءاً من معرفة قيمة x عند نهاية التفاعل و من ثم كتلتها: - كتلة أوكسيد الحديد المتبقي: 3: n = 0. 05 m o l m = n. M = 0. 05 × 160 = 8 g - نحسب كتل المواد الناتجة: F e: n = 2 x = 2 × 0. 4 m o l, M = 56 g / m o l m = n. 4 × 56 = 22. 4 g A 3: n = x = 0. 2 m o l, M = 102 g / m o l m = n. 2 × 102 = 20.
ففي هذا المثال نلاحظ أن المادة الموجودة بكمية كبيرة (اللحمة) هي المكون الذي حدد عدد الشطائر التي قمت بتحضيرها. بوسترات (لوحات) كيميائية بدقة عالية (أكثر من 25 لوحة) من تصميم الأستاذ أكرم أمير العلي تطبيقات كيميائية من تصميم الأستاذ أكرم امير العلي متوفر للجوالات التي تعمل بنظام أندرويد android على سوق جوجل بلاي google play 1 – تطبيق ملصقات الجدول الدوري باللغة العربية: بطاقات تحتوي على معلومات شاملة و مختصرة في نفس الوقت كل عنصر على حدة (اللغة العربية). 2 – تطبيق ملصقات كيميائية: ملصقات بتصميم جميل جدا للكواشف و الأدلة و الزجاجيات المستخدمة في المختبر و كذلك ملصقات و بطاقات لخزانات حفظ المواد و الأدوات الزجاجية. 3 – إذا كنت تواجه صعوبة في تحضير المحاليل الكيميائية الأكثر شيوعا في مختبرات الكيمياء و الاحياء، فهذا التطبيق سوف يساعدك كثيرا في تحضير المحاليل: مقالات قد تفيدك: شاهد أيضاً معامل المكافيء (معامل المكافىء) stoichiometric coefficient ما هو معامل المكافيء ؟ معامل المكافيء يرمز له بالرمز ( V) و هو …
بحث عن المادة المحددة للتفاعل الكيميائية – الملف
- عزل فوم بولي يوريثان
- أسطورة الحاكم الإله | القدس العربي
- محكمة الاحوال الشخصية بجدة استعلام
- آخر الاخبار
- مبارات الاهلي السعودي القادمه - مباراة الاهلي السعودي القادمة على اي قناة
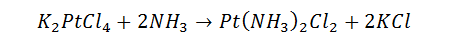
المادة المحددة للتفاعل: عند حدوث تفاعل بين عدة مواد متفاعلة فإن كمية من المواد الفائضة عن النسبة المحددة للتفاعل لا تدخل في التفاعل و بذلك فإن المادة ذات النسبة الفائضة لا تتحكم في كمية الناتج و بذلك نقول إن ا لمادة التي تتواجد بأقل نسبة وفق نسبة التفاعل هي التي تتحكم بكمية النواتج وبسير التفاعل. نمزج (10. 8g) من الألمنيوم مع (40g) من أوكسيد الحديد ليتم التفاعل: F e 2 O 3 + 2 A l ⟶ 2 F e + A l والمطلوب: عين المادة التي تبقى دون تفاعل و أحسب الكتلة المتبقية منها و أحسب كتل النواتج.. الحل: - المادة التي تبقى دون تفاعل: - في البدء نحسب عدد مولات الابتدائية المواد المتفاعلة: ( 3: 40 g A l: 10. 8 g) n = m M n 0 F = 40 160 = 0. 25 m o l 0 A l 10. 8 27 = 0. 4 m o l - بحسب معادلة التفاعل ننظم جدول سير التفاعل بحسب عدد مولات حيث n 0 عدد المولات عند البدء بالتفاعل و n t عدد المولات بعد مرور زمن t على التفاعل: F + 2 A l 2 F e + A 0: 0. 25 m o l 0. 4 m o l 0 0 t: 0. 25 − x 0. 4 − 2 x 2 x x - عند نهاية التفاعل يكون أحد المواد المتفاعلة يكون قد استهلك بشكل تام أي كون عدد مولاته معدوماَ وهي تكون المادة المحددة للتفاعل.. لذلك نقوم بالفرضين التاليين: # بفرض أن أوكسيد الحديد هو المادة المحددة للتفاعل: = 0.